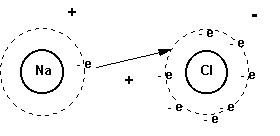
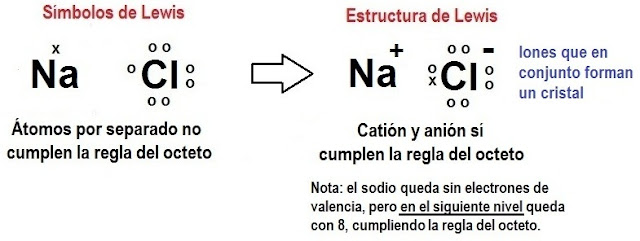
INSTITUCIÓN EDUCATIVA INEM JOSE CELESTINO MUTIS
PREPARACIÓN DE CLASE
GRADO 7
CUARTO PERIODO – QUÍMICA
COMPETENCIA:
Explica la
variación de algunas de las propiedades (densidad, temperatura de ebullición y
fusión) de sustancias simples (metales, no metales, metaloides y gases nobles)
en la tabla periódica.
CONTENIDOS:
Densidad
Temperatura de ebullición
Temperatura de fusión
DENSIDAD
es normal observar
como un cubo de hielo puede flotar en el agua, mientras que si dejamos caer una
piedra en un lago se hunde en su interior.
Este comportamiento
de los materiales, se debe a una propiedad específica de la materia denominada
densidad, la cual se representa por la letra griega rho “ρ”.
(cuyo símbolo es d o ρ), que se define como el
cociente entre la masa y el volumen de un cuerpo:
En el área de la
física y la química, la densidad de un material, bien sea líquido, solido o
gaseoso, es la relación entre su masa y volumen; densidad es igual a masa entre volumen.
De lo
cual, además, podemos deducir que la densidad es inversamente proporcional al
volumen: mientras menor sea el volumen ocupado por determinada masa, mayor será
la densidad.
Según el Sistema Internacional de Unidades,
las unidades para representar la densidad son las siguientes:
Kilogramos por metros cúbicos
(kg/m3),
Gramos por centímetros cúbicos
(g/cm3),
Kilogramos por decímetros cúbicos
(kg/dm3)
Gramos por decímetros cúbicos
(g/dm3) para los gases.
Cualquier cuerpo o sustancia posee una
determinada masa y un cierto volumen, pero en sí mismos estos datos no nos
aportan ninguna información sobre su naturaleza.
Sin embargo, la densidad es un
valor invariable, característico de cada cuerpo o sustancia. Así, un
determinado volumen de agua no puede tener una masa cualquiera, sino que esta
tiene que ser proporcional a su densidad.
Evidentemente, a mayor volumen de agua, mayor
será su masa, pero la relación que hay entre ambas será siempre la misma. Dado
que, en el Sistema Internacional, la masa se mide en kilogramos y el volumen,
en metros cúbicos, la unidad correspondiente a la densidad es el kg/m3, aunque
es común expresarlas en g/cm3:
En general, la densidad de una sustancia
disminuye al aumentar la temperatura, ya que las partículas que la componen
adquieren mayor movilidad y crecen las distancias que las separan, lo que se
traduce en un mayor volumen y en una menor densidad.
Por razones similares, la
densidad cambia bruscamente en los cambios de estados, siendo mayor en estado
sólido que en estado líquido, y mucho menor en estado gaseoso, para una misma
sustancia.
Sin embargo, existen notables excepciones, y la más relevante es la
anomalía que se observa en el agua, cuya densidad máxima se consigue en estado
líquido a 4 ºC (por lo que la densidad del hielo es menor que la del agua
líquida, lo que le permite flotar sobre ella).
Práctica de laboratorio:
INSTITUCIÓN EDUCATIVA INEM
JOSÉ CELESTINO MUTIS
PRACTICA DE LABORATORIO
DENSIDAD
Objetivos:
calcular la
densidad promedio del agua en la ciudad de armenia a una temperatura
determinada
Determinación de
densidad de sustancias sólidas, liquidas y de soluciones.
Materiales
|
Reactivos
|
balanza
|
Agua
|
probeta
|
Gaseosa
|
pipeta
|
jugo de caja
|
Picnómetro
|
solución salina
|
beaker
|
Procedimiento (primera parte): PROBETA
a) Determinación
de la densidad del agua midiendo su masa y su volumen.
1. Medir la masa
de la probeta procurando que esté limpia y seca.
2. Verter agua en
la probeta hasta los 60 ml, si es necesario utilice una pipeta para poner el
menisco en la marca deseada. Importante: El menisco del agua debe quedar
tangente a la marca del volumen que se estudia. Tenga el cuidado de que sus
ojos estén a la misma altura del nivel del líquido para disminuir los errores
asociados al proceso de medición.
3. Una vez
determinado el volumen, mida la masa de la probeta con el agua en la balanza.
Sin vaciar la
probeta agregue agua hasta una marca aproximada de 70 ml, limpie el líquido de
las paredes del recipiente, mida su masa.
4. Volver a
repetir la operación anterior para cada uno de los volúmenes aproximados
siguientes: 80, 90 y 100 mililitros. Anote los resultados en la tabla I.
Procedimiento (segunda parte): PICNÓMETRO
Variación de la densidad en función de la
concentración.
El objetivo de la práctica es calcular la densidad
del agua y de una solución salina por método más exacto.
Procedimiento:
1. Anote el valor
del volumen del picnómetro.
2. Mida la masa
del picnómetro vacío, teniéndose el cuidado de que se encuentre totalmente seco
y limpio.
3. Llénelo
completamente de las soluciones seleccionadas.
4. Mida la masa
del picnómetro lleno de líquido.
5. Determine la
densidad de las soluciones
7. Determine la
densidad de cada solución utilizando el picnómetro, siguiendo el procedimiento
del paso 3 al 5 para cada una de las soluciones.
8. Anote los
valores de la densidad para cada concentración en la tabla II.
Solución
|
Masa picnómetro vacío (g)
|
Masa picnómetro con solución (g)
|
Volumen del picnómetro (mL)
|
Densidad de la solución d= m/v
|
Agua
|
||||
solución salina
|
||||