INSTITUCIÓN EDUCATIVA INEM JOSE CELESTINO MUTIS
PREPARACIÓN DE CLASE
GRADO 7
TERCER PERIODO – QUÍMICA
COMPETENCIA: Explico y utilizo
la tabla periódica como herramienta para predecir procesos químicos (ENLACES
QUÍMICOS)
CONTENIDOS:
- Enlace Químico
- enlaces iónicos
- enlaces covalentes
- enlaces dativos.
ENLACE QUÍMICO
Es la fuerza de
atracción mutua entre dos o más átomos que se combinan para formar una
molécula, por ejemplo:
Los átomos se combinan
mediante procesos que implican perdida, ganancia o compartición de electrones
de tal forma que adquieran la configuración electrónica de 8 electrones en su
último nivel de energía; esto se conoce como Regla del Octeto.
Un enlace químico
corresponde a la fuerza que une o enlaza a dos átomos, sean estos iguales
o distintos. Los enlaces se pueden clasificar en tres grupos principales: enlaces
iónicos, enlaces covalentes y enlaces dativos.
Los enlaces se producen
como resultado de los movimientos de los electrones de los átomos, sin importar
el tipo de enlace que se forme. Pero no cualquier electrón, puede formar un
enlace, sino solamente los electrones del último nivel energético (más
externo). A estos se les llama electrones de valencia.
Enlace iónico:
Un enlace iónico se
puede definir como la fuerza que une a dos átomos a través de una cesión
electrónica.
Una cesión electrónica se da cuando un elemento electropositivo se
une con un elemento electronegativo. Mientras mayor sea la diferencia de
electronegatividad entre los elementos,
más fuerte será el enlace iónico. Se empieza a considerar que dos átomos
están unidos a través de un enlace iónico cuando su diferencia de
electronegatividad es superior a 1.7.
ELECTRONEGATIVIDAD: Es
la capacidad de un átomo para atraer a los electrones, cuando forma un enlace
químico en una molécula.
EJERCICIOS:
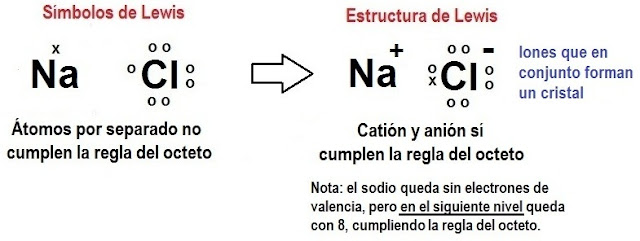
1. por medio de la distribución electrónica, el modelo atómico, la estructura de Lewis y la electronegatividad, de muestre si el siguiente compuesto forma un enlace iónico:
Cloruro de sodio (NaCl)
Electronegatividad: 3,16 - 0,93 = 2,23 este valor es mayor a 1,7 por lo tanto en un compuesto iónico.
Na = 0,93
Cl = 3,16
Configuración electrónica:
Na11 = 1s2 2s2 2p6 3s1
Cl 17 = 1s2 2s2 2p6 3s2 3p5
Modelo atómico:
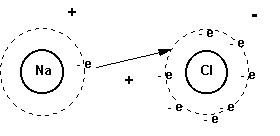
Estructura de lewis:
EJERCICIOS EN CLASE DE ENLACES IONICOS:
- Ioduro de potasio (KI)
- Cloruro de magnesio (MgCl2)
ENLACES COVALENTES
ENLACES COVALENTES
Este tipo de enlace se produce cuando los átomos se unen
comportamiento sus electrones, para alcanzar el octeto estable,
compartiendo electrones del
último nivel.
Existen los siguientes tipos de enlace covalente, a partir de la cantidad de electrones compartidos por los átomos enlazados:
- Simple. Los átomos enlazados comparten un par de electrones de su última capa (un electrón cada uno). Por ejemplo: H-H (Hidrógeno-Hidrógeno), H-Cl (Hidrógeno-Cloro).
H-H (un enlace simple)
- Doble. Los átomos enlazados aportan dos electrones cada uno, formando un enlace de dos pares de electrones. Por ejemplo: O=O (Oxígeno-Oxígeno), O=C=O (Oxígeno-Carbono-Oxígeno).
O=O (un enlace doble)
- Triple. En este caso los
átomos enlazados aportan tres pares de electrones, es
decir, seis en total. Por ejemplo: N≡N (Nitrógeno-Nitrógeno).
N≡N (un enlace triple)
- Dativo. Un tipo
de enlace covalente en que uno solo de los dos
átomos enlazados aporta dos electrones y el otro, en
cambio, ninguno.
Por otro lado, conforme a la presencia o no de polaridad, se puede distinguir entre enlaces covalentes polares (que forman moléculas polares) y enlaces covalentes no polares (que forman moléculas no polares):
- Enlaces covalentes polares. Se
enlazan átomos de distintos elementos no metálicos y con
diferencia de electronegatividad por
encima de 0,5. Así se forman
dipolos electromagnéticos.
- Enlaces covalentes no
polares. Se enlazan
átomos de un mismo elemento no metálico o de
idénticas polaridades, con una diferencia
de electronegatividad muy pequeña (menor a 0,4). La nube
electrónica, así, es
atraída con igual intensidad por ambos
núcleos y no se forma un dipolo molecular.
Ejercicios en clase:
- Ácido cianhídrico (HCN). H-C≡N (un enlace simple y uno triple)
- HCl
- SCl2
- Cl2
- H-C≡C-H (C2H2)
- F2




No hay comentarios:
Publicar un comentario